2020年5月,武漢大學(xué)人民醫院的研究團隊發(fā)表在International Journal of Infectious Diseases上的一篇文章總結了25例COVID-19死亡病例的臨床特征。
所有患者最終均死于呼吸衰竭。除了影響呼吸功能,最常見(jiàn)的器官損傷是心臟,其次是腎臟,和肝臟,表明患者死亡可能主要與心肺功能受損有關(guān)。此外,細菌感染可能在促進(jìn)患者死亡方面起重要作用[1]。
事實(shí)上,不僅僅是新冠病毒,包括每年都不得不見(jiàn)的流感病毒在內的許多病毒都具有類(lèi)似的致死機制。致病過(guò)程主要基于急性呼吸窘迫綜合癥(ARDS)。伴隨著(zhù)ARDS,患者會(huì )出現缺氧并呼吸困難,這些都提示需要上呼吸機了。
吸入氧氣雖然通常用于呼吸系統疾病患者,但會(huì )導致嚴重的肺損傷,并與人類(lèi)不良的臨床結果相關(guān)。然而,高氧、肺和腸道微生物群以及肺損傷之間的關(guān)系尚不清楚。
2020年8月,來(lái)自美國密歇根大學(xué)醫學(xué)院的Shanna L. Ashley等在Science Translational Medicine (IF= 17.956/Q1)發(fā)表了題為Lung and gut microbiota are altered by hyperoxia and contribute to oxygen-induced lung injury in mice的文章。闡明了,高氧可能會(huì )改變肺和腸道微生物種群,并且這些種群變化可能導致肺損傷。

目前的研究進(jìn)展
氧元素對人類(lèi)生存至關(guān)重要,在各種生物和生理過(guò)程中發(fā)揮重要作用。吸入氧氣廣泛用于治療急性和慢性低氧血癥。然而,吸入氧氣造成的高氧,會(huì )引起致命的肺損傷,和增加人類(lèi)的死亡率相關(guān)。高氧對肺生物學(xué)的有害影響已得到充分的證實(shí),并且這種影響在哺乳動(dòng)物中是強大的。盡管如此,高氧引起的彌漫性肺泡炎癥和損傷的機制仍未完全了解。
就微生物學(xué)的最新研究進(jìn)展,以前被認為是無(wú)菌的肺部,擁有復雜和動(dòng)態(tài)的細菌菌落。肺部微生物在健康狀態(tài)下是可檢測到的,并且在疾病中會(huì )發(fā)生改變,而且和氣道與肺泡免疫的變化相關(guān)。
呼吸衰竭患者接受高濃度治療性氧氣時(shí),肺微生物種群發(fā)生了巨大的變化。氧化應激是細菌群落結構的決定性因素。肺相關(guān)細菌對氧化應激的耐受性差異很大,從專(zhuān)性厭氧菌(e.g., Prevotella spp.)到兼性厭氧菌(e.g., Pseudomonas aeruginosa)到專(zhuān)性需氧菌 (e.g., Mycobacteria tuberculosis) 。金黃色葡萄球菌Staphylococcus aureus是呼吸相關(guān)性肺炎中最常見(jiàn)的病原體 ,已進(jìn)化出多種耐受氧化應激的機制。
肺部炎癥的特征是高氧化應激,因為先天免疫反應的一個(gè)關(guān)鍵特征是免疫系統的炎癥細胞產(chǎn)生活性氧和活性氮。此外,腸道微生物種群與患者對肺炎的易感性有關(guān)。高氧對肺和腸道微生物種群的生態(tài)影響尚不清楚,氧氣誘導的肺和腸道微生物種群被破壞的生物學(xué)重要性也是未知的。
本文得到的結論
我們證明了肺和腸道微生物種群在小鼠氧誘導肺損傷中的發(fā)病機制。急性高氧改變了鼠源肺和腸道微生物種群的細菌群落組成,使得耐氧種群(e.g., Staphylococcus spp.)的富集。
氧誘導的肺生態(tài)失調先于肺損傷的發(fā)展。對相同基因型的小鼠,分別在高氧和常氧下,相同的暴露時(shí)間,肺和腸道微生物種群的變化與肺部炎癥嚴重程度相關(guān)。
我們進(jìn)一步利用體內和體外的小鼠模型證明,氧損傷肺的微環(huán)境改變更有利于富氧類(lèi)群S. aureus增長(cháng)。

高氧打破新生小鼠肺微生物群的建立
鑒于我們觀(guān)察到的人類(lèi)數據表明高氧會(huì )改變肺微生物群,我們接下來(lái)試圖在體內模擬高氧對小鼠肺細菌群落的生態(tài)影響。我們試圖確定高氧對新生小鼠幼崽肺部微生物群的建立和破壞的急性影響,這些幼崽出生時(shí)沒(méi)有可檢測到的肺部細菌。
為了確定高氧對新生小鼠肺微生物群建立的影響,我們使用了一個(gè)完善的新生兒氧暴露模型。我們將新生小鼠幼崽 (C57BL/6) 從它們的普通窩中隨機分離,并將它們暴露于高氧 (FiO 2 75%,n = 9) 或常氧 (FiO 2 21%,n = 8) 2 周,然后表征肺微生物群使用 16 S核糖體 RNA (rRNA) 基因測序。與常氧暴露小鼠的肺相比,高氧暴露小鼠的肺群落豐富度(給定測序深度的獨特細菌分類(lèi)群的數量)降低(P = 0.03;圖 1B)。高氧對肺細菌群落組成有很大影響(P = 0.007;圖 1B)。正如mvabund和 BiPlot 分析所確定的那樣,這種差異是由一個(gè)突出的丹毒科分類(lèi)群的消除引起的(P = 0.0004;圖 1B)。這種丹參科分類(lèi)群是常氧暴露小鼠肺中最豐富的厭氧菌,但在高氧暴露小鼠中未檢測到。先前曾報道,在小鼠中,丹參科 (Erysipelotrichaceae) 富含低纖維飲食,與過(guò)敏性氣道表型相關(guān),并與肺白細胞介素 4 (IL-4) 濃度相關(guān)。相比之下,高氧暴露的小鼠耐氧鏈球菌的相對豐度增加(P = 0.02;圖 1B).
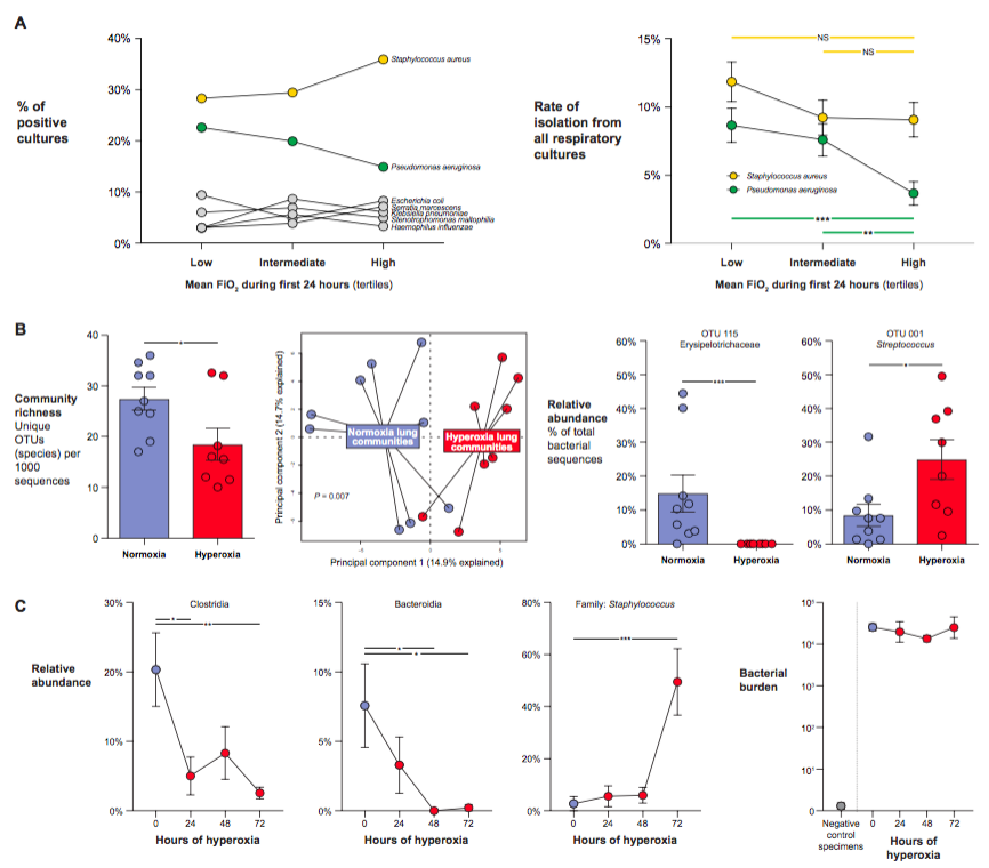
圖1.高氧改變了人類(lèi)、新生小鼠和成年小鼠的肺微生物群
展望
吸入氧,是住院患者中最常用的治療方法,與死亡率增加,嚴重的肺損傷和肺炎相關(guān)。我們的研究表明,肺與腸道生態(tài)失調可能導致氧誘導的肺損傷。未來(lái),我們還需要進(jìn)一步確定:
(i) 高氧選擇性使肺部富含耐氧細菌的機制;
(ii) 氧改變類(lèi)群促進(jìn)和抑制肺泡炎癥的途徑;
(iii) 受傷肺部?jì)鹊钠渌鷳B(tài)因素促進(jìn)和維持細菌生長(cháng);
(iv) 胃腸道微生物群在肺泡炎癥和損傷中的作用。
更好地了解氧氣在體內平衡中的作用,及其打破宿主 - 微生物群平衡,有助于了解肺和腸道微生物群的治療調節,以預防和治療氧誘導的肺損傷[2] 。
參考文獻:
[1]https://doi.org/10.1016/j.ijid.2020.03.053
[2]DOI: 10.1126/scitranslmed.aau9959
文中建立高氧模型的設備為美國B(niǎo)ioSpherix公司的精密氧氣控制系統 ProOx P110:
P110是一個(gè)多功能小型氧氣控制器。可與各種A-Chambers培養箱配合工作,配備氧氣探頭反饋控制系統,氧氣可快速到達設定值并穩定維持。任何氣體擾動(dòng)會(huì )立即檢測并及時(shí)恢復。

√ O2控制范圍0.1%~99.9%,精度0.1%;
√ 可連接N2鋼瓶(用于低氧實(shí)驗)或O2鋼瓶(用高氧實(shí)驗);
√ 適合中小尺寸動(dòng)物箱。
· 篇幅有限,產(chǎn)品還有很多迷人細節,詳情請咨詢(xún)我司獲悉,歡迎預約試用樣機

